MÉTODO DE CONCENTRACIÓN POR SEDIMENTACIÓN RITCHIE
OBJETIVO
Conocer y observar los quistes y huevos mediante un método el cual vamos a hacer y dar su determinación.
FUNDAMENTO
La prevalencia del parasitismo intestinal es alta en muchos países del mundo y la presencia de parásitos puede estar asociada a diferentes causas entre ellas factores higiénicos sanitarios que son los de mayor incidencia. El diagnóstico de los parásitos intestinales presentes en la población es cada día más necesario y más aun en los países subdesarrollados.
En 1917 Carles y Barthelemy describieron el primer método de concentración por sedimentación utilizando solución salina, éter y formaldehido, años más tarde, en 1948 Ritchie describió un método semejante, el cual hasta la fecha se sigue utilizando. En evaluaciones comparativas con este método, se ha demostrado su utilidad para el diagnóstico de parasitosis intestinales leves o moderadas. El empleo de éter y formaldehido, permite con el primero, liberar las formas parasitarias de las grasas, por disolución de las mismas y con el formol se fijan y conservan. La concentración se hace por centrifugaciones sucesivas.
El diagnóstico de las infecciones parasitarias puede establecerse de dos maneras fundamentales por métodos directos e indirectos. Dentro de los métodos directos se encuentro el método de concentración por sedimentación.
La concentración de huevos, larvas y quistes en heces ha llegado a ser un procedimiento de rutina como parte de un examen completo para la detección de los parásitos intestinales y se puede realizar como complemento del examen directo. Los procedimientos de concentración permiten la detección de protozoos y/o helmintos. Los parásitos se concentran por acción de la gravedad, suspendiendo las heces en agua corriente, agua destilada o solución salina y dejando que sedimenten naturalmente o por centrifugación. Estos métodos son principalmente útiles para la concentración de quistes, Oquistes y huevos.
El examen directo es en nuestras condiciones el menos costoso, pero en muchas ocasiones para poder obtener un diagnóstico certero es necesario el examen seriado de al menos tres muestras, de ahí la importancia de poder utilizar otros métodos. En muchos laboratorios del país se ha empleado la técnica de Ritchie como complemento del examen directo. Se basa en la concentración de los quistes y huevos por sedimentación mediante la centrifugación, con la ayuda de formol y éter para separar y visualizar los elementos parasitarios.
Unas ventajas que tiene este método es concentrar y no deformar las formas parasitarias, permite el transporte y almacenamiento de la materia fecal procesada antes de ser examinada, se usa cuando se necesita una técnica para evaluación de tratamiento y determinación de frecuencia.
MATERIAL
· Centrifuga
· Gasa
· Tubos de ensayo cónicos de 15ml
· Embudo
· Vaso de precipitado de 50ml
· Aplicadores de madera
· Pipetas Pasteur con bulbo
· Portaobjetos
· Cubreobjetos
· Microscopio
· abate lenguas
Soluciones
· Salina
· Eter
· Formaldehido al 10
· lugol
Muestra biológica
· Heces fecales
PROCEDIMIENTO
1.-Con el aplicador de madera o abate lenguas vamos a colocar aproximadamente 1gr de materia fecal, en el vaso de precipitado, sé añade 10 ml de solución salina y se homogeniza.
2.-Se filtra la suspensión a través de la gasa colocada en el embudo recogiendo el filtrado en el tubo cónico
3.-Se centrifuga lo obtenido en el tubo durante 2 por 2000rpm.
4.-Se decante el sobrenadante y se re suspende el sedimento con solución salina. Centrifugando, decantando y re suspendiendo 2 veces más.
5.-No rompemos el sedimento agregamos 5ml de formaldehido y se mezcla se deja reposar por 10 minutos.
6.-Se añaden 5ml de éter se tapan los tubos con tapones de caucho y se agitan energéticamente por 30 segundos.
7.- Se centrifuga durante 2 minutos por 2000rpm.
Al término se observaran 4 capas
- Éter en la superficie
- Un tapón de restos fecales
- Formaldehido
- Sedimento en el fondo del tubo, contenido de los elementos parasitarios.
8.-Se decanta el sobrenadante.
9.-con la pipeta Pasteur se toma un agota del sedimento y se coloca en el porta objetos.
10.-Se le añade una gota de lugol y se le agrega el cubreobjetos.
11.- Se observa la preparación en el microscopio a 10x y 40x.
Observaciones
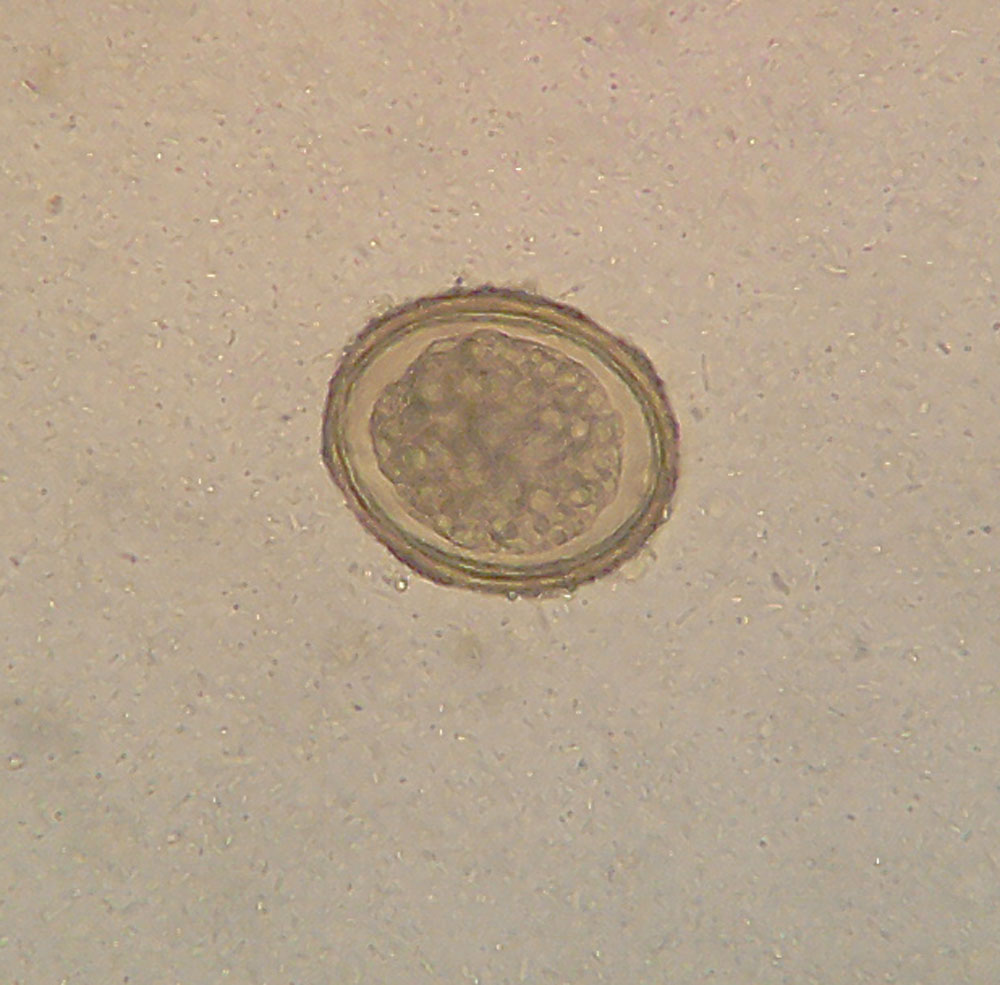
Se lograron obsevar fibras musculares y cristales de ácidos grasos, así mismo, varios quistes.
Conclusiones
Esta vez pudimos apreciar algunos quistes de parásitos La practica fue laboriosa pero es la primera vez que la realizamos y esperamos que al realizarla mas veces se nos hará mas sencillo realizarla